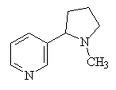
Aminas y Amidas
domingo, 21 de octubre de 2012
martes, 9 de octubre de 2012
BIBLIOGRAFIA.
-QUINTANAR León Andrés.”Guía de tareas y métodos de estudio-QUIMICA”. Ed. Letrarte, México, 2004, pp. 77.
-FLORES De Labardini Teresita. “Química orgánica”. Ed. Esfinge, México, 1993, pp. 177, 178, 180.
-FLORES De Labardini Teresita. “Guía de preguntas y respuestas- Química orgánica”. Ed. Esfinge, México, 2001, pp.174, 175, 177.
-DAUB William. “Química”. Sep edición, Ed. Pearson, México, 1996, pp. 544, 545.
AMIDAS
¿QUÉ
SON?
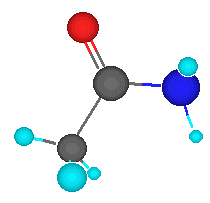
Las amidas son derivados funcionales de los ácidos carboxíliocos en los que se ha sustituido el grupo -0H por el grupo –NH2, -NHR O –NRR’.También se pueden obtener a partir de las aminas.
CLASIFICACIÓN:
Las amidas se clasifican de
acuerdo a:
NOMENCLATURA:
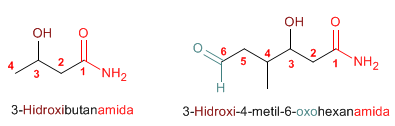
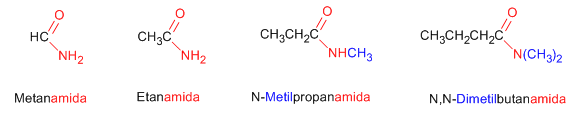
Los nombre comunes de las amidas se forman, mencionando el o los grupos alquilo en orden alfabético a continuación el sufijo –amida.





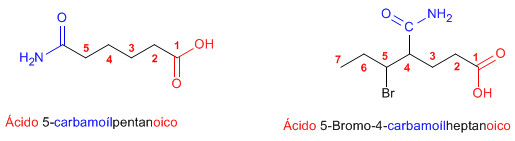
Las amidas actúan como sustituyentes cuando en la molécula hay grupos prioritarios, en este caso preceden el nombre de la cadena principal y se nombran como carbamoíl....
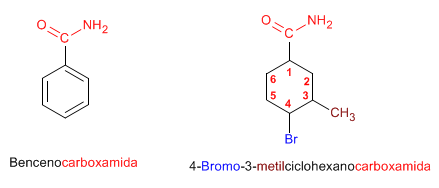
Cuando el grupo amida va unido a un ciclo, se nombra
el ciclo como cadena principal y se emplea la terminación -carboxamida para nombrar la amida.
Formamida (metanamida)
DATOS CURIOSOS:
Propiedades físicas:
Solo la formamida es líquida a la temperatura ordinaria; las demás son sólidos cristalizados.
Sus puntos de ebullición son mucho más elevados que los de los ácidos correspondientes.
Los primeros términos son solubles en agua y después la solubilidad disminuye, llegando a ser pronto prácticamente nula.

Propiedades químicas:
Deshidratación:
Las amidas son comunes en la naturaleza y se encuentran en sustancias como los aminoácidos, las proteínas, el ADN y el ARN, hormonas, vitaminas.

Es utilizada en el cuerpo para la excreción del amoníaco (NH3).
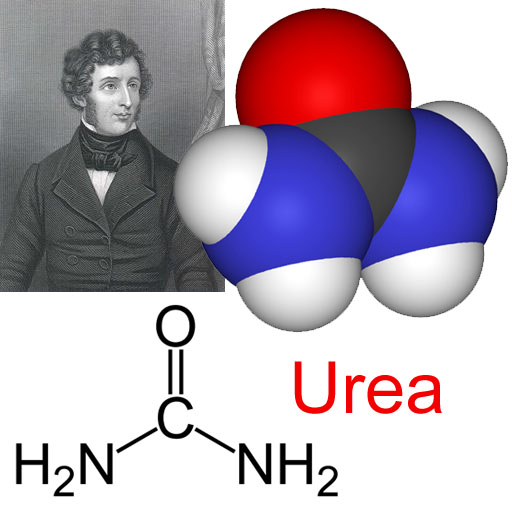
La urea: Este compuesto orgánico forma a los péptidos y a las proteínas.
USOS Y APLICACIONES DE LAS AMINAS
Usos:

Se usan en los procesos de síntesis orgánica, en la preparación de fibras sintéticas.

Son un buen disolvente para colorantes, pintura, plásticos, gomas y resinas.

En la industria parlera son aprovechados para los procesos de fabricación del papel.

Las amidas también son utilizadas en los repelentes de insectos.
Las amidas son derivados funcionales de los ácidos carboxíliocos en los que se ha sustituido el grupo -0H por el grupo –NH2, -NHR O –NRR’.También se pueden obtener a partir de las aminas.
FÓRMULA GENERAL:
CLASIFICACIÓN:
Si
tienen un hidrogeno sustituido se
conoce como amida sencilla o primaria, las que tienen dos hidrógenos sustituidos se llaman amidas
monosustituidas o secundarias
y las que tiene tres
hidrógenos sustituidos se conocen como amidas disustituidas o terciarias.
DATO: Si
todos los sustituyentes son grupos alquilo, las amidas se denominan alifáticas.
Si algún sustituyente es un grupo arilo las amidas se llaman aromáticas
NOMENCLATURA:
Los nombre comunes de las amidas se forman, mencionando el o los grupos alquilo en orden alfabético a continuación el sufijo –amida.





En las amidas secundarias y
terciarias, si un radical se repite se utilizan los prefijos “di-” o
“tri-“, aunque para evitar confusiones, se escoge el radical de mayor valor
y los demás se nombran anteponiendo una N para
indicar que están unidos al átomo de nitrógeno.

Las amidas
son grupos prioritarios frente a aminas, alcoholes, cetonas, aldehídos y
nitrilos.
Las amidas actúan como sustituyentes cuando en la molécula hay grupos prioritarios, en este caso preceden el nombre de la cadena principal y se nombran como carbamoíl....
Formamida (metanamida)
Es
un líquido miscible con agua en todas proporciones
Se
puede obtener por métodos generales, en particular por deshidratación del
formiato de amonio por el calor o con amoníaco y formiato de etilo.
Se
prepara industrialmente, sobre todo como materia prima del ácido cianhídrico HCN, con óxido de carbono y amoníaco a
presión a 100°C:
Acetamida (etanamida)
Acetamida (etanamida)
Es
un sólido cristalizado, perfectamente pura es inodora, pero las impurezas le
dan un olor llamado de ratón. Muy soluble en agua, es muy higroscópica.
DATOS CURIOSOS:
Propiedades físicas:
Solo la formamida es líquida a la temperatura ordinaria; las demás son sólidos cristalizados.
Sus puntos de ebullición son mucho más elevados que los de los ácidos correspondientes.
Los primeros términos son solubles en agua y después la solubilidad disminuye, llegando a ser pronto prácticamente nula.

Propiedades químicas:
Hidrólisis
(o saponificación)
La
hidrólisis de una amida se efectua hirviendo a la amida con solución acuosa o
alcohólica de una base alclina (sponificación), o calentando la amida a 100°C
conun exceso de un ácido mineral fuerte concentrado.
Se
puede también pasar al ácido utilizado la acción de ácido nitroso naciente. Se
trata la amida con un ácido mineral en presencia de nitrito de sodio a 0°C y después
se calienta a 50°C.
Deshidratación:
La
deshidratación de una amida da el nitrilo correspondiente, lo que se puede
lograr por la acción de un agente deshidratante pentóxido de fósforo, anhídrido
acético hirviendo o cloruro de tionilo en caliente .
¿DÓNDE SE ENCUENTRAN?

Es utilizada en el cuerpo para la excreción del amoníaco (NH3).

La urea: Este compuesto orgánico forma a los péptidos y a las proteínas.
USOS Y APLICACIONES DE LAS AMINAS

Se usan en los procesos de síntesis orgánica, en la preparación de fibras sintéticas.

Son un buen disolvente para colorantes, pintura, plásticos, gomas y resinas.

En la industria parlera son aprovechados para los procesos de fabricación del papel.

Las amidas también son utilizadas en los repelentes de insectos.
Como emulsificantes,
se usan especialmente para pH bajos, debido a su estabilidad en estas
condiciones.
Además se usan como antitranspirantes y
como neutralizantes.
Otra aplicación es como dispersantes de
jabones cálcicos.
Aplicaciones
Las amidas se usan
principalmente como agentes espumantes y espesantes.
Los productos
obtenidos por condensación 1:1 no resultan ser buenos emulsificantes.
Los condensados 2:1 (también llamados condensados de Kritchevsky) se
usan a veces como emulsificantes o como acondicionadores del cabello.
AMINAS.
¿QUÉ SON?
 |
¿QUÉ SON?
Las aminas son derivados orgánicos del amoniaco, formadas por la sustitución de uno, dos o tres hidrógenos, por grupos alquilo o arilo. El grupo funcional es -NH2.
FÓRMULA GENERAL:
CnH2n+3N
CLASIFICACIÓN:
Las aminas se clasifican de acurdo a que si tiene un hidrogeno sustituido se conoce como amina primaria, las que tienen dos hidrógenos sustituidos se llaman aminas secundarias y las que tiene tres hidrógenos sustituidos se conocen como aminas terciarias.

DATO: Si todos los sustituyentes son grupos alquilo las aminas se denominan alifáticas. Si algún sustituyente es un grupo arilo las aminas se llaman aromáticas.
NOMENCLATURA:
Los nombre comunes de las aminas se forman, mencionando el o los grupos alquilo en orden alfabético y a continuación el sufijo –amina.
Etilamina
Dietilamina
Fenilisobutilmetilamina
Etilamina
Dietilamina
Fenilisobutilmetilamina
Etilmetilpropilamina
En las aminas secundarias y terciarias, si un radical se repite se utilizan los prefijos “di-” o “tri-“, aunque para evitar confusiones, se escoge el radical de mayor valor y los demás se nombran anteponiendo una N para indicar que están unidos al átomo de nitrógeno.
En las aminas secundarias y terciarias, si un radical se repite se utilizan los prefijos “di-” o “tri-“, aunque para evitar confusiones, se escoge el radical de mayor valor y los demás se nombran anteponiendo una N para indicar que están unidos al átomo de nitrógeno.


La nomenclatura en las aminas aromáticas es similar, como derivados de la anilina si el nitrógeno esta unido al anillo bencénico.

m-metilamina o-bromoanilina
DATOS CURIOSOS:
*Los puntos de bullición de las aminas primarias y secundarias son mayores que de los alcanos y menores que de los alcoholes de peso molecular semejante, esto se explica por la formación de puentes de hidrogeno más débiles en las aminas que entre los alcoholes. 

*El punto de ebullición de las aminas terciarias es solo ligeramente mayor que los de los alcanos.
*Las tres clases de aminas con cinco átomos de carbono o menos, son solubles en agua, debido a que pueden formar puentes de hidrogeno con el agua. También son solubles en disolventes menos polares como el éter, alcohol, benceno, etc.
*Las metilaminas y las etilaminas tiene olor similar al amoníaco, las alquilaminas de peso molecular elevado tiene olor a pescado. Las aminas aromáticas son por lo general toxicas.
*Las aminas alifáticas tiene bases más fuertes que al amoniaco, y reaccionan fácilmente con los asidos minerales, formando sales solubles en agua. La basicidad de las aminas disminuye conforme aumenta el número de anillos aromáticos, unidos al átomo de hidrogeno.
*Las aminas más importantes son las aromáticas y entre ellas destaca la fenilamina o anilina. La anilina es un líquido incoloro poco soluble en agua que se emplea como materia prima en la fabricación de colorantes.
¿DÓNDE SE ENCUENTRAN?
Las aminas se encuentran formando parte de la naturaleza, en los aminoácidos que conforman las proteínas que son un componente esencial del organismo de los seres vivos. Al degradarse las proteínas se descomponen en distintas aminas, como cadaverina y putrescina entre otras. Las cuales emiten olor desagradable. Es por ello que cuando la carne de aves, pescado y res no es preservada mediante refrigeración, los microorganismos que se encuentran en ella degradan las proteínas en aminas y se produce un olor desagradable.
Las aminas son parte de los alcaloides que son compuestos complejos que se encuentran en las plantas. Algunos de ellos son la morfina y la nicotina. Algunas aminas son biológicamente importantes como la adrenalina y la noradrenalina.
Las aminas secundarias que se encuentran en las carnes y los pescados o en el humo del tabaco.
Estas aminas pueden reaccionar con los nitritos presentes en conservantes empleados en la alimentación y en plantas, procedentes del uso de fertilizantes, originando N-nitrosoaminas secundarias, que son carcinógenas.
Las aminas secundarias que se encuentran en las carnes y los pescados o en el humo del tabaco.
Estas aminas pueden reaccionar con los nitritos presentes en conservantes empleados en la alimentación y en plantas, procedentes del uso de fertilizantes, originando N-nitrosoaminas secundarias, que son carcinógenas.

USOS Y APLICACIONES DE LAS AMINAS
Las aminas se pueden aplicar en varios campos:
* Colorantes.
* Jabones.
* Desinfectantes.
APLICACIONES EN LA MEDICINA
* MORFINA: Es un analgésico, empleado en casos de extrema necesidad, provoca dependencia.
* CODEÍNA: Es un derivado de la morfina que se emplea como un antitusivo.
* ANFETAMINA: Es un estimulante de la corteza cerebral, tiene un uso restringido ya que genera una dependencia.

* NICOTINA: Es un compuesto orgánico, un alcaloide encontrado en la planta del tabaco, En bajas concentraciones, la sustancia es un estimulante y es uno de los principales factores de adicción al tabaco.
*COCAINA: Es un anestesico y estimulante del sistema nervioso, pero en altas dosis genera una alta dependencia en el cuerpo humano.
*COLORANTES NATURALES: Pueden ser minerales, vegetales o animales.
*COLORANTES VEGETALES: Encontramos el indigo, la alizarina y la hemateina.
*COLORANTES SINTÉTICOS: Las aminas son fundamentales en los colorantes sintéticos pues son su materia prima.
*Alizarina, acido picrico y la anilina.
- POLARES: Acidos básicos que se adieren a el material
- NITROCOLORANTES: Son derivados polinitrados de los fenoles y se encuentran en un posición orto o para.
- AZOICOS: Poseen el grupo funcional azo. El ácido nitroso reacciona con la anilina, y forman una sal de diazonio.
- MORDIENTE: Estos no se fijan de manera estable a las fibras ya que son demasiado solubles.
Suscribirse a:
Comentarios (Atom)